国内首证!科炬生物HIV三线试剂获欧盟最高等级认证
近日,天津中新科炬生物制药股份有限公司(以下简称“科炬生物”)迎来体外诊断领域的重大突破 —— 自主研发的 HIV (1+2) 三线抗体快检试剂盒(人类免疫缺陷病毒 (1+2) 三线分型快速检测试剂盒),成功通过欧盟《体外诊断医疗器械法规》(IVDR, (EU) 2017/746)认证,斩获CE IVDR CLASS D证书。
该产品也是中国首个获得 IVDR 最高风险等级认证的HIV三线产品,不仅是科炬生物技术实力与合规能力的见证,更填补了国内HIV三线诊断产品,在欧盟最高级别认证领域的空白。

欧盟 IVDR 法规自2017年5月25日发布以来,便以更严苛的标准重塑体外诊断器械监管体系。相较于原 IVDD 98/79/EC “清单式”分类(List A/B/ 自我检测 / 其他),IVDR 采用基于风险的A、B、C、D四类分级,其中D类为最高风险等级,对产品临床证据完整性、技术文件严谨性提出极致要求,且需公告机构(NB)介入审核的产品比例从 IVDD 时期的 10%-20% 大幅提升至 80%-90%。而 HIV 检测试剂作为保障公共卫生安全的核心产品,被明确划入 IVDR CLASS D 类别,认证难度堪称行业标杆。
面对法规升级带来的挑战,科炬生物早布局、早行动,作为国内首批启动 IVDR 注册的企业,凭借对技术研发的深耕和对产品品质的严苛把控,历经欧盟权威机构层层审核,最终成功突围,让中国自主研发的 HIV 三线诊断产品首次站上欧盟最高风险等级认证的舞台,彰显了中国体外诊断企业的核心竞争力。
从市场前景来看,科炬生物此次获证正契合欧盟体外诊断市场的发展需求。据国际市场调查数据显示,2024年 HIV 和 HCV 快检试剂在欧盟市场的占有率已达30%-35%,且随着欧盟对公共卫生防控重视程度的提升,市场对高质量试剂盒的采购需求持续增长,未来五年复合年增长率(CAGR)预估为3.44%,市场空间广阔。与此同时,欧盟 IVDR 法规实施后,未达标的产品将逐步退出市场,科炬生物作为国内首个拿下 IVDR CLASS D 认证的 HIV 三线产品企业,将凭借“首证”先发优势,快速抢占欧盟市场份额,在全球竞争中占据有利地位。
科炬公司HIV(1+2)产品为三线分型产品,是将HIV-1和HIV-2抗原分别包被在NC膜的两条检测线上,能区分I、Ⅱ型的不同感染,产品设计决定了科炬公司的抗体检测灵敏度更高:因为单独包被HIV-1 和HIV-2在NC膜上的两条检测线上,能够发挥每种抗原的最佳包被效果,抗原表位充分表露,灵敏度更强。
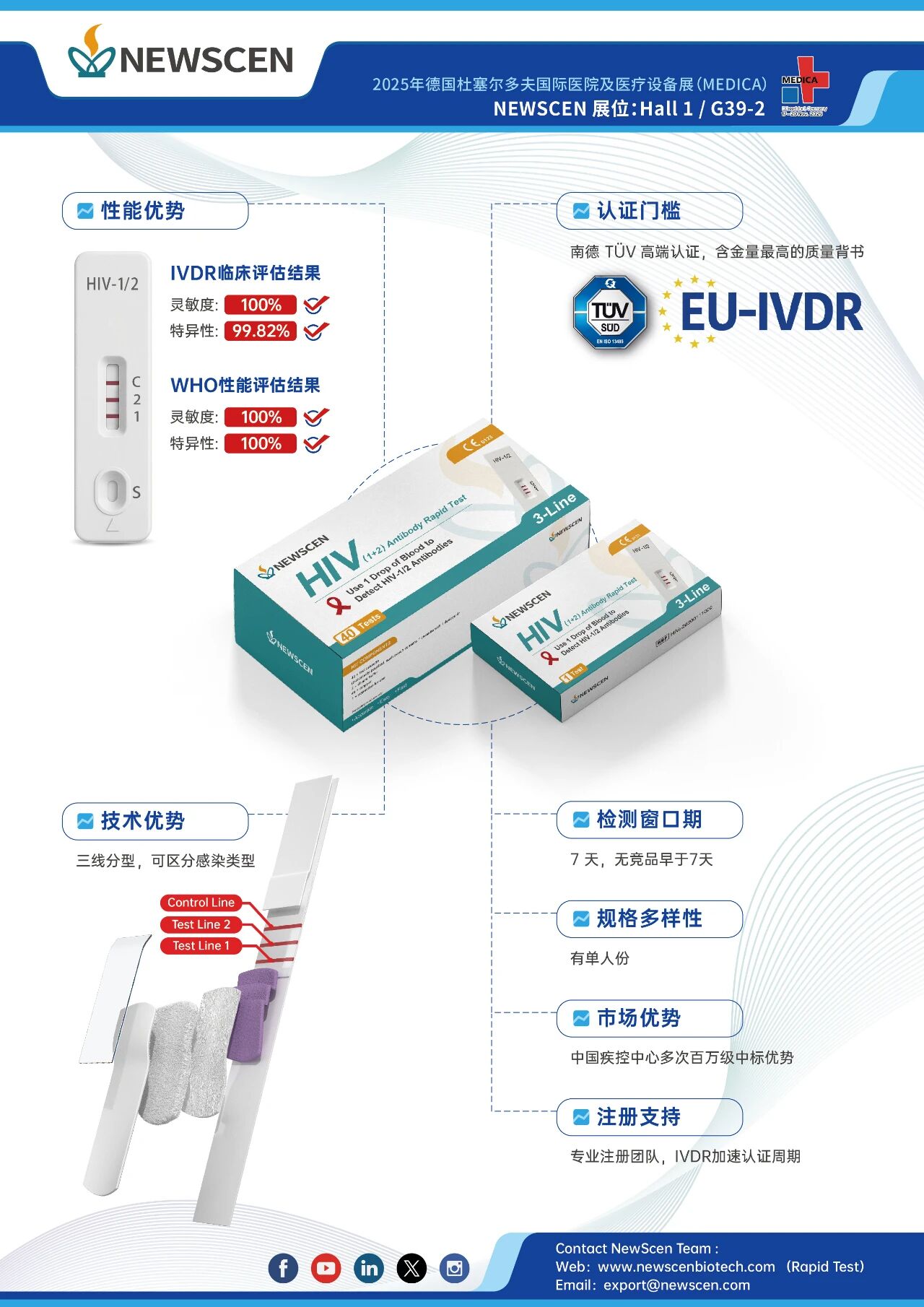
血清转化盘测试结果显示:科炬生物的HIV(1+2)产品最早第7天可检测出抗体,目前无竞品早于7天,阳性检出数量明显优于其他快检产品。
WHO性能评估结果:灵敏度100%,特异性100%;IVDR临床评估结果:灵敏度100%,特异性99.82%。产品不但具备性能优势,而且具备成本优势,科炬生物还特别推出了1人份规格,尤其适合在基层开展高危人群筛查使用。
此次“国内首证”的获得,不仅是科炬生物的里程碑,更是中国体外诊断产业迈向高端化、国际化的重要一步。目前,科炬生物正面向全球招募合作伙伴,诚邀各界有识之士携手,以优质的HIV三线诊断产品为纽带,共同开拓全球市场,为全球公共卫生安全贡献中国力量,让“中国首证”的价值惠及更多国家和地区。


 津公网安备12010202000359号
津公网安备12010202000359号
